Выбор читателей
Популярные статьи
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3. Реакции окисления и восстановления.
Альдегиды и кетоны содержат карбонильную группу
С=О. Общая формула:
1. Методы получения.

2. Химические
свойства.
Альдегиды и кетоны – один из наиболее реакционноспособных классов
органических соединений. Их химические свойства определяются присутствием
карбонильной группы. Вследствие большого различия в электроотрицательностях
углерода и кислорода и высокой поляризуемости p
-связи связь С=О обладает значительной полярностью
(m
С=О
=2,5-2,8 D). Атом углерода карбонильной
группы несет эффективный положительный заряд и является объектом для атаки
нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции
нуклеофильного присоединения Ad
N . Кроме того, карбонильная группа оказывает влияние на
реакционную способность связи С-Н в
a
-положении, повышая ее кислотность.
Таким образом, молекулы альдегидов и кетонов
содержат два основных реакционных центра – связь С=О и связь С-Н в
a
-положении:

2.1. Реакции нуклеофильного
присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи.
Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем
образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и
дает продукт присоединения:

Активность карбонильных соединений в
Ad
N –реакциях зависит от величины
эффективного положительного заряда на карбонильном атоме углерода и объема
заместителей у карбонильной группы. Электронодонорные и объемистые заместители
затрудняют реакцию, электроноакцепторные заместители повышают реакционную
способность карбонильного соединения. Поэтому альдегиды в
Ad
N –реакциях активнее, чем
кетоны.
Активность карбонильных соединений повышается в
присутствии кислотных катализаторов, которые увеличивают положительный заряд на
карбонильном атоме углерода:

Альдегиды и кетоны присоединяют воду, спирты,
тиолы, синильную кислоту, гидросульфит натрия, соединения типа
NH
2 X. Все реакции присоединения
идут быстро, в мягких условиях, однако образующиеся продукты, как правило,
термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание
продуктов присоединения в равновесной смеси может быть низким.
Присоединение воды.
Альдегиды и кетоны присоединяют воду с
образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты
термодинамически не стабильны. Равновесие смещено в сторону продуктов
присоединения только в случае активных карбонильных соединений.

Продукт гидратации трихлоруксусного альдегида
хлоральгидрат – устойчивое кристаллическое соединение, которое используется в
медицине как успокаивающее и снотворное средство.
Присоединение спиртов и
тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей
. При избытке спирта и в присутствии кислотного катализатора
реакция идет дальше – до образования ацеталей

Реакция образования полуацеталя протекает как
нуклеофильное присоединение и ускоряется в присутствии кислот или
оснований.

Процесс образования ацеталя идет как
нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях
кислотного катализа, когда группа ОН превращается в хорошую уходящую группу
(H
2 O).

Образование ацеталей – обратимый процесс. В
кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде
гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в
химии углеводов.
Кетоны в аналогичных условиях кеталей не
дают.
Тиолы как более сильные нуклеофилы, чем спирты,
образуют продукты присоединения и с альдегидами, и с кетонами.
Присоединение синильной
кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях
основного катализа с образованием циангидринов.

Реакция имеет препаративное значение и
используется в синтезе
a
-гидрокси- и
a
-аминокислот (см. лек. № 14). Плоды некоторых растений
(например, горький миндаль) содержат циангидрины. Выделяющаяся при их
расщеплении синильная кислота оказывает отравляющее действие
.
Присоединение бисульфита
натрия.
Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO 3 c образованием бисульфитных производных.

Бисульфитные производные карбонильных соединений
– кристаллические вещества, не растворимые в избытке раствора бисульфита натрия.
Реакция используется выделения карбонильных соединений из смесей. Карбонильное
соединение может быть легко регенерировано обработкой бисульфитного производного
кислотой
или щелочью.
Взаимодействие с соединениями общей
формулы NH
2 X.
Реакции протекают по общей схеме как процесс
присоединения-отщепления. Образующийся на первой стадии продукт присоединения не
устойчив и легко отщепляет воду.

По приведенной схеме с карбонильными
соединениями реагируют аммиак, первичные амины, гидразин, замещенные гидразины,
гидроксиламин.

Образующиеся производные представляют собой
кристаллические вещества, которые используют для выделения и идентификации
карбонильных соединений.
Имины (основания Шиффа) являются промежуточными
продуктами во многих ферментативных процессах (трансаминирование под действием
кофермента пиридоксальфосфата; восстановительное аминирование кетокислот при
участии кофермента НАД
Н). При каталитическом гидрировании иминов образуются
амины. Процесс используется для синтеза аминов из альдегидов и кетонов и
называется восстановительным аминированием.
Восстановительное аминирование протекает in vivo
в ходе синтеза аминокислот (см. лек. № 16)
2.2. Реакции по a -углеродному атому.
Кето-енольная таутомерия.
Водород в
a
-положении к карбонильной группе обладает кислотными
свойствами, так как образующийся при его отщеплении анион стабилизируется за
счет резонанса.

Результатом протонной подвижности атома водорода
в
a
-положении
является способность карбонильных соединений к образованию енольных форм за счет
миграции протона из
a
-положения к атому кислорода карбонильной группы.

Кетон и енол являются таутомерами
.
Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга
за счет миграции какой-либо группы (в данном случае – протона). Равновесие между
кетоном и енолом называют кето-енольной таутомерией.
Процесс енолизации катализируется кислотами и
основаниями. Енолизация под действием основания может быть представлена
следующей схемой:
Большинство карбонильных соединений существуют
преимущественно в кетонной форме. Содержание енольной формы возрастает с
увеличением кислотности карбонильного соединения, а также в случае
дополнительной стабилизации енольной формы за счет водородной связи или за счет
сопряжения.
Таблица 8. Содержание енольных форм и
кислотность карбонильных соединений
Например, в 1,3-дикарбонильных соединениях
подвижность протонов метиленовой группы резко увеличивается за счет
электроноакцепторного влияния двух карбонильных групп. Кроме того, енольная
форма стабилизируется за счет наличия в ней системы сопряженных
p
-связей и внутримолекулярной
водородной связи.

Если соединение в енольной форме представляет
собой сопряженную систему с высокой энергией стабилизации, то енольная форма
преобладает. Например, фенол существует только в енольной форме.
Енолизация и образование енолят-анионов являются
первыми стадиями реакций карбонильных соединений, протекающих по
a
-углеродному атому. Важнейшими
из них являются галогенирование
и альдольно-кротоновая
конденсация
.
Галогенирование.
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl 2 ,
Br 2 , I 2 ) с образованием
исключительно
a
-галогенпроизводных.

Реакция катализируется кислотами или
основаниями. Скорость реакции не зависит от концентрации и природы галогена.
Процесс протекает через образование енольной формы (медленная стадия), которая
затем реагирует с галогеном (быстрая стадия). Таким образом, галоген не
участвует в скорость
—определяющей стадии
процесса.

Если карбонильное соединение содержит несколько
a
-водородных
атомов, то замещение каждого последующего происходит быстрее, чем предыдущего,
вследствие увеличения их кислотности под действием электроноакцепторного влияния
галогена. В щелочной среде ацетальдегид и метилкетоны дают
тригалогенпроизводные, которые затем расщеплятся под действием избытка щелочи с
образованием тригалогенметанов (галоформная реакция)
.
Расщепление трииодацетона протекает как реакция
нуклеофильного замещения. группы CI
3 — гидроксид-анионом, подобно S
N -реакциям в карбоксильной группе (см. лек. №12).
Иодоформ выпадает из реакционной смеси в виде
бледно-желтого кристаллического осадка с характерным запахом. Иодоформную
реакцию используют в аналитических целях для обнаружения соединений типа
СH
3 -CO-R, в том числе в
клинических лабораториях для диагностики сахарного диабета.
Реакции конденсации.
В присутствии каталитических количеств кислот
или щелочей карбонильные соединения, содержащие
a
-водородные атомы,
претерпевают конденсацию с образованием
b
-гидроксикарбонильных соединений.

В образовании связи С-С участвуют карбонильный
атом углерода одной молекулы (карбонильной компоненты
) и
a
-углеродный атом другой
молекулы (метиленовой компоненты
). Эта реакция носит название альдольной конденсации
(по названию продукта конденсации ацетальдегида –
альдоля).
При нагревании реакционной смеси продукт легко
дегидратируется с образованием
a
,b
-непредельного карбонильного
соединения.

Такой тип конденсации носит название кротоновой
(по названию продукта конденсации ацетальдегида – кротонового
альдегида).
Рассмотрим механизм альдольной конденсации в
щелочной среде. На первой стадии гидроксид-анион отрывает протон из
a
-положения карбонильного
соединения с образованием енолят-аниона. Затем енолят анион как нуклеофил
атакует карбонильный атом углерода другой молекулы карбонильного соединения.
Образующийся тетраэдрический интермедиат (алкоксид-анион) является сильным
основанием и отрывает далее протон от молекулы воды.

При альдольной конденсации двух различных
карбонильных соединений (перекрестная альдольная конденсация) возможно
образование 4-х разных продуктов. Однако этого можно избежать, если одно из
карбонильных соединений не содержит
a
-водородных атомов (например, ароматические альдегиды
или формальдегид) и не может выступать в качестве метиленовой компоненты.

В качестве метиленовой компоненты в реакциях
конденсации могут выступать не только карбонильные соединения, но и другие
С-Н-кислоты. Реакции конденсации имеют препаративное значение, так как позволяют
наращивать цепь углеродных атомов. По типу альдольной конденсации и
ретроальдольного распада (обратный процесс) протекают многие биохимические
процессы: гликолиз, синтез лимонной кислоты в цикле Кребса, синтез нейраминовой
кислоты.
2.3. Реакции окисления и
восстановления
Восстановление
Карбонильные соединения восстанавливаются до
спиртов в результате каталитического гидрирования или под действием
восстановителей, которые являются донорами гидрид-анионов.

[H]: H 2 /кат., кат. – Ni, Pt,
Pd;
LiAlH 4 ; NaBH 4 .
Восстановление карбонильных соединений
комплексными гидридами металлов включает нуклеофильную атаку карбонильной группы
гидрид-анионом. При последующем гидролизе образуется спирт.
Аналогично происходит восстановление
карбонильной группы in vivo под действием кофермента НАД
Н, который является
донором гидрид-иона (см. лек. №19).
Окисление
Альдегиды окисляются очень легко практически
любыми окислителями, даже такими слабыми, как кислород воздуха и соединения
серебра (I) и меди
(II).
Две последние реакции используются как
качественные на альдегидную группу.
В присутствии щелочей альдегиды, не содержащие
a
-водородных атомов
диспропорционируют с образованием спирта и кислоты (реакция Канницаро).
2HCHO + NaOH ® HCOONa + CH 3 OH
Это является причиной того, что водный раствор
формальдегида (формалин) при длительном хранении приобретает кислую
реакцию.
Кетоны устойчивы к действию окислителей в
нейтральной среде. В кислой и щелочной средах под действием сильных
окислителей
(KMnO 4 ) они
окисляются с разрывом связи С-С. Расщепление углеродного скелета происходит по
двойной углерод-углеродной связи енольных форм карбонильного соединения, подобно
окислению двойных связей в алкенах. При этом образуется смесь продуктов,
содержащая карбоновые кислоты или карбоновые кислоты и кетоны.
|
Т омский государственный университет |
||
|
кафедра органической химии |
||
|
Альдегиды и кетоны |
||
Альдегиды и кетоны отличаются наличием карбонильной группы >С =О.
Карбонильная группа поляризована по связи С-О :
Альдегиды и кетоны можно рассматривать, как производные алканов , у которых одна из метильных (-СН 3 ) или метиленовых групп (-СН 2 - ) заменена на карбонильную группу:

Кетоны имеют в качестве заместителей при карбонильной группе два алкильных
радикала, тогда как в альдегидах один заместитель-
алкильная группа, другой- водород. Такое различие
приводит к существенным различиям в химических свойствах (см
. ниже).
Номенклатура
Номенклатура IUPAC
При наименовании альдегидов и кетонов по правилам номенклатуры ИЮПАК выбирается самая длинная цепь углеродов, включающая в себе карбонильную группу. Нумерация атомов углерода в этой цепи производится с того края, куда ближе карбонильная группа, а при формировании названия к названию углеводорода, соответствующему числу атомов углерода в основной цепи (1-метан, 2- этан, 3-пропан, 4-бутан, 5 –пентан и т.д.) прибавляется окончание -а ль (для альдегидов) или -он для кетонов.
Положение карбонильной группы у кетонов указывается через тире, если возможно существование нескольких изомеров. Положение карбонильной группы альдегидов не указывается цифрой, поскольку во всех случаях она оказывается под первым номером:

Рациональная номенклатура
Кетоны часто называют по радикалам, соединенным через карбонильную группу, с добавлением слова кетон . Например, гексанон-3 или метилэтилкетон , ацетон или диметилкето н .
Альдегиды могут быть названы, как производные этаналя или уксусного альдегида:
Другое название- триметилэтаналь .
Химические свойства карбонильных соединений
Все реакции карбонильных соединений можно разделить на группы:
Реакции по карбонильной группе (присоединение)
Реакции по углеродному скелету
Реакции окисления
Реакции восстановления
Реакции присоединения по карбонильной группе (присоединение нуклеофильных реагентов)
1. присоединение воды

Образующиеся гем-диолы неустойчивы и равновесие в этой реакции сильно смещено влево. Исключение составляют альдегиды и кетоны с электроноакцепторными группами, например, хлораль или гексафторацетон , которые в водной среде существуют в виде гем-диолов :

2. присоединение бисульфита

Присоединение идет через более нуклеофильный атом серы, а не кислорода, хотя на нем и имеется отрицательный заряд. Образуются производные алкансульфокислот (соли алканоксисульфокислот ).
Образующиеся аддукты нерастворимы в насыщенном растворе бисульфита натрия или спиртах и выпадают в осадок в виде кристаллов. Так можно отделять карбонильные соединения из смеси со спиртами. Карбонильное соединение выделяется в свободном виде из аддукта при обработке его кислотой.
При реакции с кетонами бисульфиты присоединяются только к метилкетонам СН 3 -СО-R .
3. присоединение цианидов

Реакция катализируется цианистым калием или натрием. Образующиеся оксинитрилы (или циангидрины ) могут быть гидролизованы до оксикарбоновых кислот:
4. присоединение спиртов
При присоединении первой молекулы спирта образуются полуацетали . Реакция катализируется кислотами или основаниями:

Присоединение второй молекулы спирта приводит к образованию ацеталей . Образование ацеталей катализируется только в кислой среде:

Ацетали устойчивы в нейтральной и щелочной среде, поэтому могут быть использованы для временной защиты альдегидных групп. Ацетали широко распространены в природе.
5. присоединение реактивов Гриньяра
Взаимодействие металлорганических соединений типа R-Mg-X (реактивы Гриньяра ), где Х= галоген, с карбонильными группами(нуклеофильное присоединение по кратной связи С =О):

Взаимодействие с формальдегидом, альдегидами, кетонами - приводит к первичным, вторичным и третичным спиртам, соответственно.
Из кетонов получаются третичные спирты. Так, из метилэтилкетона
(бутанон-2) получается
2-метилбутанол-2. Альдегиды в подобной реакции дают вторичные спирты. Из пропионового
альдегида (пропаналь
) получается бутанол-2:
Из формальдегида образуются первичные спирты. При взаимодействии реактивов Гриньяра
с галогенангидридами
карбоновых кислот и сложными
эфирами образуются третичные спирты, у которых имеется два одинаковых алкильных
заместителя. При этом расходуется два моля реактива Гриньяра
:

6. Присоединение аммиака и аминов
Первичные амины присоединяются к альдегидам и кетонам с образованием иминов (оснований Шиффа :

Аналогичная реакция вторичных аминов с карбонильными соединениями дает енамины :

С карбонильными соединениями могут вступать во взаимодействие также гидразин и его производные с образованием гидразонов :

Гидроксиламины присоединяются к альдегидам и кетонам с образованием альдоксимов и кетоксимов :

7. Альдольно-кротоновая конденсация
Конденсация может происходить как в кислой среде, так и в щелочной.
Катализируемая кислотой конденсация
В конденсацию вступают енол
и протонированная
карбонильная группа второй молекулы соединения:
Конденсация, катализируемая основанием
Образование енолят-иона
, генерирующего
карбанион
, протекает по
схеме:
Далее карбанион
присоединяется к карбонильной группе второй молекулы, причем протекает С-алкилирование
, в отличие от термодинамически
невыгодного О-
алкилирования
:
Образующийся альдегидоспирт (альдоль ) легко теряет воду в присутствии каталитических количеств оснований или кислот, а также при незначительном нагревании, с образованием a ,b - ненасыщенного карбонильного соединения, этим завершается реакция конденсации (R ,Х= алкил или Н):

Таким образом, в реакцию альдольно - кротоновой конденсации (в том числе и самоконденсации ) могут вступать как альдегиды, так и кетоны, имеющие альфа-углеродные атомы водорода. В случае кетонов положение равновесия невыгодно для образования продуктов, тем не менее, проводя реакцию в особых условиях (например, исключая контакт продукта с катализатором основного характера) можно добиваться существенных выходов. Перекрестные реакции между альдегидами и кетонами не имеют лабораторного применения, поскольку образуется трудноразделяемая смесь из четырех продуктов и непрореагировавших исходных соединений. Чаще в синтетических целях проводят реакцию между двумя карбонильными соединениями, одно из которых является источником карбанионов (метиленовая компонента ), а другое служит карбонильной компонентой (не имеющей альфа-углеродных атомов водорода). Обычно в роли карбонильной компоненты используются формальдегид, ароматические альдегиды, эфиры угольной, щавелевой и муравьиной кислот. В качестве метиленовой компоненты применяют в том числе и С-Н кислоты и даже производные ацетиленовых углеводородов с концевой тройной связью.
8. Реакция Канниццаро
Альдегиды, не имеющие альфа-углеродных атомов водорода при нагревании с сильными основаниями вступают в реакцию окисления-восстановления, когда одна из молекул восстанавливается до спирта за счет окисления второй молекулы до карбоновой кислоты. Такие реакции носят название реакции Канниццаро , и протекают по схеме:

Известны и внутримолекулярные реакции окисления-восстановления:

C воеобразной разновидностью внутримолекулярного окисления-восстановления является Бензиловая перегруппировка :
Реакции по углеродному скелету альдегидов и кетонов
Реакции, затрагивающие углеродный скелет, включают:
Кето-енольная таутомерия альдегидов и кетонов;
Галогенирование (галоформная реакция и замещение a - углеродных атомов водорода)
1. Кето-енольная таутомерия
Карбонильные соединения могут сосуществовать в двух формах- кетонной и енольной :

Превращения альдегидов и кетонов в енолы (непредельные спирты) протекает как самопроизвольно, так и с катализом кислотами и основаниями. Енольные формы хоть и присутствуют в альдегидах и кетонах в незначительных концентрациях, но роль в их реакционной способности играют существенную. Через образование енолов идет целый ряд важных реакций альдегидов и кетонов. Рассмотрим механизмы перехода кетонных форм в енольные , протекающие при каталитическом действии кислот и оснований.
Енолизация , катализируемая кислотой
Образование енола может катализироваться кислотой согласно нижеприведенной схеме (R "= алкил или Н):
Реакция начинается с протонирования атома кислорода карбонильной группы и завершается отщеплением протона уже от альфа-углеродного атома. Таким образом, формально протон играет роль катализатора.
Енолизация , катализируемая основанием
Образование енолят-иона протекает по схеме:
В образовании енолов при катализе основаниями важную роль играет кислотность альфа- углеродных атомов водорода. Их повышенная кислотность связана с близким соседством с карбонильной группой и ее отрицательным индуктивным эффектом, оттягивающим электроны связи С-Н и облегчающим таким образом отщепление протона. Другими словами, отщепление протона облегчено потому, что образующийся карбанион стабилизирован делокализацией отрицательного заряда на карбонильную группу.
К образовавшимся енолам присоединяются галогены по кратной связи С =С. Только в отличие от алкенов , где такое присоединение завершается полным связыванием галогена, у альдегидов и кетонов присоединяется только один атом галогена (на соседний с карбонильной группой углерод). Второй атом галогена (на карбонильную группу) не присоединяется, а реакция завершается отщеплением протона и регенерацией карбонильной группы:
В кислой среде реакция на этом и останавливается. Замещения второго атома водорода на галоген не происходит. А вот в щелочной среде происходит быстрая реакция замещения второго, и еще более быстрая реакция замещения третьего атома углерода на галоген (увеличение числа атомов галогена при углероде резко усиливает кислотность его водородов):
В конечном итоге все три атома водорода оказываются замещены на галогены, после чего следует отщепление группировки СХ 3 в виде аниона, с последующим немедленным обменом протоном:
В результате образуется тригалогенметан , называемый галоформом (иодоформ CHJ 3 , бромоформ CHBr 3 , хлороформ CHCl 3) и анион карбоновой кислоты. А сам процесс называется галоформной реакцией. Галоформной реакции подвержены любые метилкетоны . Галоформы выпадают в виде окрашенного осадка (желтый иодоформ ), имеют специфический запах и могут служить качественной реакцией на присутствие метилкетонов . Галоформную реакцию дают также спирты, при окислении которых могут образоваться метилкетоны (например, изопропанол ). Окисление осуществляется избыточным количеством галогена.
Окисление альдегидов и кетонов
Альдегиды легко окисляются до соответствующих кислот:
Кетоны окисляются с трудом, в жестких условиях. Окисление сопровождается
разрывом С-С
связи по соседству с карбонильной
группой. В результате получается набор продуктов окисления-
карбоновые кислоты с разной длиной углеродной цепи:

Методы получения
1. Окислением первичных спиртов получают альдегиды, а вторичные спирты дают кетоны:

Окисление можно осуществлять «сухим» и «мокрым» методами. Первый заключается в пропускании паров спирта через нагретую до 300-350 С окись меди CuO . «Мокрым» методом называется окисление спиртов подкисленным раствором бихромата калия или натрия:
При окислении «мокрым» методом образующийся альдегид следует отгонять из сферы реакции, в противном случае он легко окисляется дальше, до карбоновой кислоты:
2. Альдегиды и кетоны получаются при гидролизе гем-дигалогеналканов

Вначале происходит замещение двух атомов галогена на гидроксильные группы. Но
неустойчивые гем-диолы
быстро перегруппировываются в карбонильные соединения с отщеплением молекулы
воды:
3. Озонолиз
алкенов
приводит к образованию смесей альдегидов и кетонов, в зависимости от строения исходного алкена :
На первом этапе озонирования получается озонид , при разложении которого водой образуются карбонильные соединения и перекись водорода. Чтобы перекись не спровоцировала дальнейшее окисление альдегидов, в воду при разложении озонидов добавляют цинковую пыль. Озонирование алкенов имеет целью не столько синтез альдегидов и кетонов, сколько определение места положения кратной связи:

4. Присоединение воды к алкинам
Присоединение воды к тройной связи в присутствии солей ртути приводит в случае ацетилена к уксусному альдегиду, а в случае замещенных ацетиленов- к кетонам. Вода присоединяется по правилу Марковникова :
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.

У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.

Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
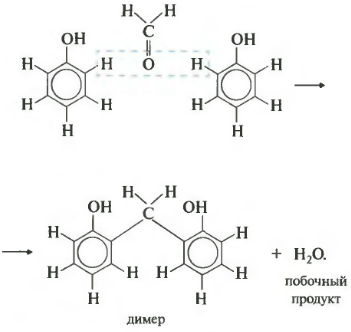
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
1. Окисление спиртов. Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
При окислении вторичных спиртов образуются кетоны:
2. Гидратация алкинов (реакция Кучерова). Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны получают при гидратации других гомологов ацетилена:
3. Окисление алкенов (катализаторы - хлориды Pd и Cu):
4. Кумольный способ получения ацетона и фенола (Кружалов, Сергеев, Немцов):
5. Реакция оксосинтеза:
6. Восстановление хлорангидридов карбоновых кислот:
7. Карбонильные соединения являются промежуточными продуктами окисления углеводородов до кислот.
Химические свойства альдегидов и кетонов. Электронная структура карбонильной группы определяет реакционную способность альдегидов и кетонов. Атом углерода карбонильной группы находится в состоянии sp 2 -гибридизации. Валентный угол между δ- связями 120 0 . Неспаренный р- электрон углерода перекрывается с р- электроном кислорода и образует π- связь, которая располагается перпендикулярно плоскости молекулы альдегида. Электронная плотность π- связи смещена к кислороду. Исходя из этого, типичными реакциями альдегидов и кетонов являются:
─ реакции нуклеофильного замещения (Ad N);
─ реакции окисления;
─ реакции с участием атомов водорода в α- положении в карбонильной группе.
Реакции нуклеофильного присоединения. Реакции нуклеофильного присоединения протекают через стадию образования промежуточного комплекса, который характеризуется изменением типа гибридизации исходного альдегида. Молекула принимает тип гибридизации, который будет в конечных продуктах реакции. Механизм реакции имеет вид:
1. Взаимодействие с синильной кислотой:
Кетоны в реакции Ad N вступают труднее, чем альдегиды. Это связано с пространственными препятствиями алкильных радикалов кетонов при образовании промежуточной структуры.
2. Присоединение гидросульфита натрия:
С гидросульфитом натрия вступают во взаимодействие только метилкетоны.
Реакции карбонильных соединений с гидросульфитом натрия используются для очистки продуктов от карбонильных соединений.
3. Взаимодействие с аммиаком:
Взаимодействие кетонов с аммиаком происходит иначе:
4. Взаимодействие с гидроксиламином. При взаимодействии карбонильных соединений с гидроксиламином образуются оксимы:
Эта реакция используется для количественного определения карбонильных соединений в реакционных смесях, различных продуктах. При этом используется солянокислый гидроксиламин (NH 2 -OH HCl).
5. Взаимодействие альдегидов с гидразином:
Аналогично взаимодействуют кетоны.
6. Взаимодействие с фенилгидрозином:
7. Реакции гидрирования. При восстановлении альдегидов образуются первичные спирты. При восстановлении кетонов образуются вторичные спирты. При восстановлении кетонов водородом в момент выделения возможно образование пинаконов.
8. Взаимодействие альдегидов со спиртами:
Реакции окисления. Окисление карбонильных соединений протекает в мягких условиях. Альдегиды окисляются до карбоновых кислот. Кетоны окисляются до смеси кислот с разрывом углеводородной цепочки:
Реакции серебряного зеркала:
Реакции с участием α- водородных атомов. В альдегидах и кетонах атомы водорода в α- положении к углероду карбонильной группы очень подвижны и способны диссоциировать по типу кислоты.
Подвижность протонов в α- положении обусловлена акцепторным влиянием кислорода, снижающим электронную плотность на углероде в α- положении.
Структура ІІІ энергетически стабильна, так как стабилизирована резонансом. Структура ІІІ является гибридом двух структур: І и ІІ.
1. Реакция бромирования.
Альдегиды и кетоны – это производные углеводородов, содержащие функциональную карбонильную группу СО . В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами.
Общие формулы:
Названия распространенных веществ этих классов приведены в табл. 10.
Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %‑ного раствора– формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества.
Простейший кетон – пропанон‑2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, t кип = 56,24 °C. Хорошо смешивается с водой.
Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.
В результате присоединения водорода к альдегидам образуются первичные спирты:
При восстановлении водородом кетонов образуются вторичные спирты:
Реакция присоединения гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
(действием разбавленных кислот такие продукты превращаются в альдегиды).
Окисление альдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению.
Альдегиды способны участвовать в реакциях конденсации . Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно:
Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации – фенолформальдегидная смола:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
Аналогично протекает реакция с Cu(ОН) 2 , при нагревании появляется красный осадок оксида меди (I) Cu 2 O.
Получение : общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичных спиртов получают альдегиды , а при дегидрировании вторичных спиртов – кетоны . Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью:
При окислении первичных спиртов сильными окислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот:
Более подходящим окислителем является оксид меди (II):
Ацетальдегид в промышленности получают по реакции Кучерова (см. 19.3).
Наибольшее применение из альдегидов имеют метаналь и этаналь. Метаналь используют для производства пластмасс (фенопластов), взрывчатых веществ, лаков, красок, лекарств. Этаналь – важнейший полупродукт при синтезе уксусной кислоты и бутадиена (производство синтетического каучука). Простейший кетон – ацетон используют в качестве растворителя различных лаков, ацетатов целлюлозы, в производстве кинофотопленки и взрывчатых веществ.
| Статьи по теме: | |
|
Норманны и нормандцы. В чём разница? Норманны Почему норманны
Слово «викинг» восходит к древненорвежскому «викингр». Относительно его... Эпидемия: определение. БЖД. Общие сведения об эпидемиях. Причины возникновения эпидемических очагов. Возбудители инфекции Эпидемии причины возникновения
Эпидемия – быстрое распространение инфекционной болезни среди населения,... Институциональная теория торстейна веблена
Помимо этого, мотивом к накоплению является власть, даруемая богатством.... | |